Leflunomida




O que é
A Leflunomida pertence a um grupo de medicamentos designados de anti-reumáticos.
Trata-se de um moderno agente imunomodulador que corresponde, quimicamente, a um derivado isoxazólico.
Seu mecanismo de acção, em função do bloqueio selectivo da enzima deidrorotato-desidrogenase, está directamente relacionado com a biossíntese de novo da pirimidina.
Trata-se de um moderno agente imunomodulador que corresponde, quimicamente, a um derivado isoxazólico.
Seu mecanismo de acção, em função do bloqueio selectivo da enzima deidrorotato-desidrogenase, está directamente relacionado com a biossíntese de novo da pirimidina.
Usos comuns
A Leflunomida é usada no tratamento de doentes com artrite reumatóide activa ou com artrite psoriática activa.
Os sintomas da artrite reumatóide incluem inflamação das articulações, tumefação, dificuldade de movimentação e dores.
Outros sintomas que afectam todo o corpo incluem perda de apetite, febre, perda de energia e anemia (falta de glóbulos vermelhos).
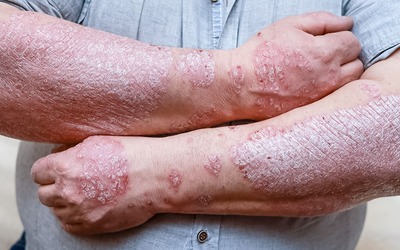
Os sintomas da artrite psoriática activa incluem inflamação das articulações, tumefação, dificuldade de movimentação, dores e manchas vermelhas, pele escamosa (lesões na pele).
Os sintomas da artrite reumatóide incluem inflamação das articulações, tumefação, dificuldade de movimentação e dores.
Outros sintomas que afectam todo o corpo incluem perda de apetite, febre, perda de energia e anemia (falta de glóbulos vermelhos).
Os sintomas da artrite psoriática activa incluem inflamação das articulações, tumefação, dificuldade de movimentação, dores e manchas vermelhas, pele escamosa (lesões na pele).
Tipo
Molécula pequena.
Indicações
A leflunomida está indicada no tratamento de doentes adultos com:
– artrite reumatóide activa, como um "medicamento anti-reumático modificador da doença" (MARMD),
– artrite psoriática activa.
O tratamento recente ou concomitante com MARMD com toxicidade hepática ou hematológica (p.ex. metotrexato) pode aumentar o risco de ocorrência de reacções adversas graves; consequentemente, o início da terapêutica com leflunomida deve ser ponderado com precaução, tendo em consideração estes aspetos de benefício/risco.
Para além do mais, uma mudança de tratamento para outro MARMD sem cumprir o procedimento de washout pode aumentar a possibilidade de riscos aditivos, mesmo durante um longo período de tempo após a alteração.
– artrite reumatóide activa, como um "medicamento anti-reumático modificador da doença" (MARMD),
– artrite psoriática activa.
O tratamento recente ou concomitante com MARMD com toxicidade hepática ou hematológica (p.ex. metotrexato) pode aumentar o risco de ocorrência de reacções adversas graves; consequentemente, o início da terapêutica com leflunomida deve ser ponderado com precaução, tendo em consideração estes aspetos de benefício/risco.
Para além do mais, uma mudança de tratamento para outro MARMD sem cumprir o procedimento de washout pode aumentar a possibilidade de riscos aditivos, mesmo durante um longo período de tempo após a alteração.
Classificação CFT
16.3 : IMUNOMODULADORES
Mecanismo de ação
O A771726, metabólito activo da leflunomida, inibe a enzima humana di-hidroorotato desidrogenase (DHODH) e apresenta actividade antiproliferativa.
A leflunomida é um agente antirreumático modificador da doença com propriedades antiproliferativas.
A leflunomida é eficaz em modelos animais de artrite e de outras doenças auto-imunes e transplantes, principalmente se for utilizada durante a fase de sensibilização.
Tem características imunomoduladoras/imunosupressoras, actua como agente antiproliferativo e apresenta propriedades anti-inflamatórias.
A leflunomida revela os melhores efeitos protectores em modelos animais de doenças auto-imunes quando administrada na fase inicial da progressão da doença.
In vivo, é rápida e quase completamente metabolizada em A771726, que é activo in vitro, e se presume ser responsável pelo efeito terapêutico.
A leflunomida é um agente antirreumático modificador da doença com propriedades antiproliferativas.
A leflunomida é eficaz em modelos animais de artrite e de outras doenças auto-imunes e transplantes, principalmente se for utilizada durante a fase de sensibilização.
Tem características imunomoduladoras/imunosupressoras, actua como agente antiproliferativo e apresenta propriedades anti-inflamatórias.
A leflunomida revela os melhores efeitos protectores em modelos animais de doenças auto-imunes quando administrada na fase inicial da progressão da doença.
In vivo, é rápida e quase completamente metabolizada em A771726, que é activo in vitro, e se presume ser responsável pelo efeito terapêutico.
Posologia orientativa
– Na artrite reumatóide: a terapêutica com leflunomida é normalmente iniciada com uma dose de carga de 100 mg, uma vez por dia, durante 3 dias.
A omissão da dose de carga pode diminuir o risco de acontecimentos adversos.
A dose de manutenção recomendada é de 10 a 20 mg de leflunomida, uma vez por dia, dependendo da gravidade (actividade) da doença.
– Na artrite psoriática: a terapêutica com leflunomida é iniciada com uma dose de carga de 100 mg, uma vez por dia, durante 3 dias.
A dose de manutenção recomendada é de 20 mg de leflunomida uma vez por dia.
O efeito terapêutico inicia-se habitualmente após 4 a 6 semanas e a melhoria pode acentuar-se até 4 a 6 meses.
Não se recomenda ajustamento da dose em doentes com insuficiência renal ligeira.
Não é necessário ajustamento da posologia em doentes com idade superior a 65 anos.
População pediátrica: A utilização de leflunomida não é recomendada em doentes com idade inferior a 18 anos dado que a segurança e a eficácia não foram estabelecidas na artrite reumatóide juvenil (ARJ)
A omissão da dose de carga pode diminuir o risco de acontecimentos adversos.
A dose de manutenção recomendada é de 10 a 20 mg de leflunomida, uma vez por dia, dependendo da gravidade (actividade) da doença.
– Na artrite psoriática: a terapêutica com leflunomida é iniciada com uma dose de carga de 100 mg, uma vez por dia, durante 3 dias.
A dose de manutenção recomendada é de 20 mg de leflunomida uma vez por dia.
O efeito terapêutico inicia-se habitualmente após 4 a 6 semanas e a melhoria pode acentuar-se até 4 a 6 meses.
Não se recomenda ajustamento da dose em doentes com insuficiência renal ligeira.
Não é necessário ajustamento da posologia em doentes com idade superior a 65 anos.
População pediátrica: A utilização de leflunomida não é recomendada em doentes com idade inferior a 18 anos dado que a segurança e a eficácia não foram estabelecidas na artrite reumatóide juvenil (ARJ)
Administração
O tratamento deverá ser iniciado e supervisionado por especialistas com experiência no tratamento de artrite reumatóide e artrite psoriática.
Os comprimidos de Leflunomida devem ser tomados inteiros, com uma quantidade suficiente de líquido.
A extensão da absorção de leflunomida não é afectada pela sua administração em conjunto com os alimentos.
Os comprimidos de Leflunomida devem ser tomados inteiros, com uma quantidade suficiente de líquido.
A extensão da absorção de leflunomida não é afectada pela sua administração em conjunto com os alimentos.
Contraindicações
• Hipersensibilidade à Leflunomida (sobretudo na presença de antecedentes de
síndrome de Stevens-Johnson, necrose epidérmica tóxica ou eritema multiforme),
• Doentes com disfunção hepática,
• Doentes com estados de imunodeficiência grave, por exemplo, com SIDA,
• Doentes com insuficiência medular óssea significativa ou anemia, leucopenia, neutropenia ou ltrombocitopenia significativas por outras causas que não as relacionadas com a artrite reumatóide ou artrite psoriática,
• Doentes com infecções graves,
• Doentes com insuficiência renal moderada a grave, dado não haver experiência clínica suficiente neste grupo de doentes,
• Doentes com hipoproteinemia grave, por exemplo no síndrome nefrótico
• Mulheres grávidas ou mulheres em idade fértil que não utilizam métodos contraceptivos eficazes durante o tratamento com leflunomida, e em seguida enquanto os níveis plasmáticos dos metabólitos activos estiverem acima de 0.02 mg/l.
Deve-se verificar se já existe gravidez antes da administração de leflunomida,
• Mulheres a amamentar
síndrome de Stevens-Johnson, necrose epidérmica tóxica ou eritema multiforme),
• Doentes com disfunção hepática,
• Doentes com estados de imunodeficiência grave, por exemplo, com SIDA,
• Doentes com insuficiência medular óssea significativa ou anemia, leucopenia, neutropenia ou ltrombocitopenia significativas por outras causas que não as relacionadas com a artrite reumatóide ou artrite psoriática,
• Doentes com infecções graves,
• Doentes com insuficiência renal moderada a grave, dado não haver experiência clínica suficiente neste grupo de doentes,
• Doentes com hipoproteinemia grave, por exemplo no síndrome nefrótico
• Mulheres grávidas ou mulheres em idade fértil que não utilizam métodos contraceptivos eficazes durante o tratamento com leflunomida, e em seguida enquanto os níveis plasmáticos dos metabólitos activos estiverem acima de 0.02 mg/l.
Deve-se verificar se já existe gravidez antes da administração de leflunomida,
• Mulheres a amamentar
Efeitos indesejáveis/adversos
Informe o médico imediatamente e pare de tomar Leflunomida:
- se se sente fraco, com a cabeça leve ou tonto ou se tem dificuldade em respirar, uma vez que podem ser sinais de reacção alérgica grave,
- se desenvolveu uma erupção cutânea ou feridas na boca, uma vez que estas podem indicar reacções graves, e que podem por vezes ser fatais (p.ex., síndrome de Stevens-Johnson, necrólise epidérmica tóxica, eritema multiforme).
Informe o médico imediatamente caso tenha sentido os seguintes efeitos indesejáveis:
- palidez, cansaço, ou nódoas negras, uma vez que podem indicar problemas no sangue provocados por um desequilíbrio nos diferentes tipos de células envolvidas no fabrico do sangue;
- cansaço, dor abdominal ou icterícia (coloração amarela dos olhos ou da pele), uma vez que estes podem indicar problemas graves tais como falência hepática, que pode ser fatal,
- qualquer sintoma de infecção tais como febre, anginas ou tosse, uma vez que este medicamento pode aumentar as hipóteses de uma infecção grave que pode ser potencialmente fatal,
- tosse ou problemas respiratórios, dado que estes podem indicar inflamação dos pulmões (doença pulmonar intersticial).
- formigueiros anormais, fraqueza ou dor nas mãos ou pés, uma vez que estes podem indicar problemas nos nervos (neuropatia periférica).
Efeitos secundários frequentes (podem afectar 1 em cada 100 pessoas)
- uma diminuição ligeira do número de glóbulos brancos (leucopenia),
- reacções alérgicas ligeiras,
- perda de apetite, perda de peso (normalmente insignificante),
- cansaço (astenia),
- cefaleias, tonturas,
- sensações anormais na pele como formigueiro (parestesia),
- ligeiro aumento da pressão arterial,
- diarreia,
- náuseas, vómitos,
- inflamação da boca ou ulceração da boca,
- dores abdominais,
- aumento dos valores de alguns testes hepáticos,
- aumento da perda de cabelo,
- eczema, pele seca, erupção cutânea, comichão,
- tendinite (dor provocada pela inflamação da membrana que envolve os tendões, normalmente nos pés e nas mãos),
- um aumento de algumas enzimas no sangue (creatinina fosfoquinase).
- problemas nos nervos das mãos ou pernas (neuropatia periférica).
Efeitos secundários pouco frequentes (podem afectar 1 em cada 1000 pessoas)
- uma diminuição do número de glóbulos vermelhos (anemia) e uma diminuição do número de plaquetas (trombocitopenia),
- uma diminuição dos níveis de potássio no sangue,
- ansiedade,
- alterações do paladar,
- urticária,
- ruptura de tendões,
- um aumento nos níveis de gordura no sangue (colesterol e triglicéridos),
- uma diminuição dos níveis de fosfato no sangue.
Efeitos secundários raros (podem afectar 1 em cada 10.000 pessoas)
- um aumento do número de células sanguíneas chamados eosinofílios (eosinofilia); diminuição ligeira do número de glóbulos brancos (leucopenia); diminuição do número de todas células sanguíneas (pancitopenia),
- aumento acentuado da pressão arterial,
- inflamação pulmonar (doença pulmonar intersticial),
- um aumento dos valores de alguns testes do fígado, que pode evoluir para situações graves como hepatite e icterícia,
- infecções graves designadas de sepsis que podem ser fatais,
- aumento de certas enzimas no sangue (lactato desidrogenase).
Efeitos secundários muito raros (podem afectar menos de 1 em cada 10.000 pessoas)
- uma diminuição marcada de alguns glóbulos brancos (agranulocitose),
- reacções alérgicas graves ou potencialmente graves,
- inflamação dos pequenos vasos (vasculite, incluindo vasculite cutânea necrosante),
- problemas nos nervos dos braços e pernas (neuropatia periférica),
- inflamação do pâncreas (pancreatite),
- lesões hepáticas graves, tais como falência hepática ou necrólise que podem por vezes ser fatais,
- reacções graves que podem por vezes ser fatais (síndrome de Stevens-Johnson, necrólise epidérmica tóxica, eritema multiforme).
Outros efeitos secundários tais como falência renal, diminuição dos níveis de ácido úrico no seu sangue, e infertilidade masculina (que é reversível assim que o tratamento com este medicamento é parado), lúpus cutâneo (caracterizado por erupção cutânea/eritema nas áreas da pele que estão expostas à luz) e psoríase (aparecimento ou agravamento) podem também ocorrer com uma frequência desconhecida.
- se se sente fraco, com a cabeça leve ou tonto ou se tem dificuldade em respirar, uma vez que podem ser sinais de reacção alérgica grave,
- se desenvolveu uma erupção cutânea ou feridas na boca, uma vez que estas podem indicar reacções graves, e que podem por vezes ser fatais (p.ex., síndrome de Stevens-Johnson, necrólise epidérmica tóxica, eritema multiforme).
Informe o médico imediatamente caso tenha sentido os seguintes efeitos indesejáveis:
- palidez, cansaço, ou nódoas negras, uma vez que podem indicar problemas no sangue provocados por um desequilíbrio nos diferentes tipos de células envolvidas no fabrico do sangue;
- cansaço, dor abdominal ou icterícia (coloração amarela dos olhos ou da pele), uma vez que estes podem indicar problemas graves tais como falência hepática, que pode ser fatal,
- qualquer sintoma de infecção tais como febre, anginas ou tosse, uma vez que este medicamento pode aumentar as hipóteses de uma infecção grave que pode ser potencialmente fatal,
- tosse ou problemas respiratórios, dado que estes podem indicar inflamação dos pulmões (doença pulmonar intersticial).
- formigueiros anormais, fraqueza ou dor nas mãos ou pés, uma vez que estes podem indicar problemas nos nervos (neuropatia periférica).
Efeitos secundários frequentes (podem afectar 1 em cada 100 pessoas)
- uma diminuição ligeira do número de glóbulos brancos (leucopenia),
- reacções alérgicas ligeiras,
- perda de apetite, perda de peso (normalmente insignificante),
- cansaço (astenia),
- cefaleias, tonturas,
- sensações anormais na pele como formigueiro (parestesia),
- ligeiro aumento da pressão arterial,
- diarreia,
- náuseas, vómitos,
- inflamação da boca ou ulceração da boca,
- dores abdominais,
- aumento dos valores de alguns testes hepáticos,
- aumento da perda de cabelo,
- eczema, pele seca, erupção cutânea, comichão,
- tendinite (dor provocada pela inflamação da membrana que envolve os tendões, normalmente nos pés e nas mãos),
- um aumento de algumas enzimas no sangue (creatinina fosfoquinase).
- problemas nos nervos das mãos ou pernas (neuropatia periférica).
Efeitos secundários pouco frequentes (podem afectar 1 em cada 1000 pessoas)
- uma diminuição do número de glóbulos vermelhos (anemia) e uma diminuição do número de plaquetas (trombocitopenia),
- uma diminuição dos níveis de potássio no sangue,
- ansiedade,
- alterações do paladar,
- urticária,
- ruptura de tendões,
- um aumento nos níveis de gordura no sangue (colesterol e triglicéridos),
- uma diminuição dos níveis de fosfato no sangue.
Efeitos secundários raros (podem afectar 1 em cada 10.000 pessoas)
- um aumento do número de células sanguíneas chamados eosinofílios (eosinofilia); diminuição ligeira do número de glóbulos brancos (leucopenia); diminuição do número de todas células sanguíneas (pancitopenia),
- aumento acentuado da pressão arterial,
- inflamação pulmonar (doença pulmonar intersticial),
- um aumento dos valores de alguns testes do fígado, que pode evoluir para situações graves como hepatite e icterícia,
- infecções graves designadas de sepsis que podem ser fatais,
- aumento de certas enzimas no sangue (lactato desidrogenase).
Efeitos secundários muito raros (podem afectar menos de 1 em cada 10.000 pessoas)
- uma diminuição marcada de alguns glóbulos brancos (agranulocitose),
- reacções alérgicas graves ou potencialmente graves,
- inflamação dos pequenos vasos (vasculite, incluindo vasculite cutânea necrosante),
- problemas nos nervos dos braços e pernas (neuropatia periférica),
- inflamação do pâncreas (pancreatite),
- lesões hepáticas graves, tais como falência hepática ou necrólise que podem por vezes ser fatais,
- reacções graves que podem por vezes ser fatais (síndrome de Stevens-Johnson, necrólise epidérmica tóxica, eritema multiforme).
Outros efeitos secundários tais como falência renal, diminuição dos níveis de ácido úrico no seu sangue, e infertilidade masculina (que é reversível assim que o tratamento com este medicamento é parado), lúpus cutâneo (caracterizado por erupção cutânea/eritema nas áreas da pele que estão expostas à luz) e psoríase (aparecimento ou agravamento) podem também ocorrer com uma frequência desconhecida.
Advertências

Gravidez:A leflunomida está contra-indicada durante a gravidez.

Aleitamento:As mulheres que amamentam não devem ser tratadas com leflunomida.

Insuf. Renal:Usar com precaução (não há informação).

Condução:Em caso de efeitos secundários, tais como tonturas, a capacidade de concentração e de reacção do doente pode ser afectada. Nestes casos, os doentes não deverão conduzir nem utilizar máquinas.
Precauções gerais
Não é aconselhável a administração concomitante de MARMDs hepatotóxicos ou hematotóxicos (p.ex. metotrexato).
O metabólito activo da leflunomida, A771726, tem uma semi-vida longa (habitualmente 1 a 4 semanas).
Podem ocorrer acontecimentos adversos graves (por exemplo, toxicidade hepática, toxicidade hematológica ou reacções alérgicas), mesmo quando o tratamento com leflunomida é interrompido.
Consequentemente, quando este tipo de efeitos tóxicos ocorre ou, se por qualquer razão é necessário remover rapidamente do organismo o A771726, o procedimento de washout terá de ser seguido.
O procedimento poderá ser repetido se clinicamente necessário.
Para mais detalhes sobre os procedimentos de washout e outras medidas recomendadas em caso de gravidez desejada ou inesperada.
Reacções hepáticas
Foram notificados casos raros de lesões hepáticas graves, incluindo casos com desfecho fatal, durante o tratamento com leflunomida.
A maioria dos casos ocorreu durante os primeiros 6 meses de tratamento.
O tratamento concomitante com outros medicamentos hepatotóxicos foi frequentemente observado nestes casos.
É considerado essencial uma adesão rigorosa às recomendações de monitorização.
A ALT (SGPT) deve ser controlada antes do início do tratamento com leflunomida e com a mesma frequência que o hemograma completo (de 2 em 2 semanas), durante os primeiros 6 meses de tratamento, e posteriormente de 8 em 8 semanas.
Em caso de elevações da ALT (SGPT) entre 2 a 3 vezes acima do limite superior do normal, pode considerar-se uma redução da dose de 20 mg para 10 mg e a monitorização deverá ser realizada semanalmente.
Se persistirem elevações de ALT (SGPT) de mais de 2 vezes acima do limite superior do normal, ou se registarem elevações de ALT superiores a 3 vezes o limite superior do normal, a leflunomida deve ser interrompida e deve ser iniciado o procedimento de washout.
É recomendável manter a monitorização das enzimas hepáticas após descontinuação do tratamento com leflunomida, até que os valores das enzimas hepáticas tenham normalizado.
Devido a um potencial para efeitos hepatotóxicos aditivos, recomenda-se que o consumo de álcool seja evitado durante o tratamento com leflunomida.
Uma vez que o metabólito activo da leflunomida, A771726 está altamente ligado às proteínas e é excretado por metabolismo hepático e secreção biliar, é de esperar que os níveis plasmáticos de A771726 estejam aumentados em doentes com hipoproteinémia.
A leflunomida está contra-indicada em doentes com hipoproteinémia grave ou insuficiência hepática.
Reacções hematológicas
Antes do início do tratamento com leflunomida, e simultâneamente com a ALT deve ser efectuado um hemograma completo, incluindo a contagem diferencial dos leucócitos e plaquetas.
Estas análises devem ser repetidas de 2 em 2 semanas, durante os primeiros 6 meses de terapêutica, e de 8 em 8 semanas, daí em diante.
Nos doentes com anemia, leucopénia e/ou trombocitopénia pré-existentes, assim como nos doentes com insuficiência da medula óssea ou nos doentes em risco de supressão medular, o risco de distúrbios hematológicos encontra-se aumentado.
Se este tipo de reacção ocorrer, deve ser considerado um período de washout, de modo a reduzir os níveis plasmáticos de A771726.
Nos casos de reacções hematológicas graves, incluindo a pancitopénia, o tratamento com leflunomida ou com quaisquer outros fármacos mielossupressores deve ser interrompido, dando-se início a um procedimento de washout da leflunomida.
Associação com outras terapêuticas
A utilização de leflunomida em conjunto com os antimaláricos utilizados nas doenças reumatológicas (p. ex., cloroquina e hidroxicloroquina), sais de ouro intramusculares e orais, D-penicilamina, azatioprina e outros agentes imunossupressores (com excepção do metotrexato) não foi ainda estudada.
O risco associado à terapêutica combinada, em particular nos casos de tratamento a longo prazo, é desconhecido.
Uma vez que este tipo de tratamentos pode condicionar toxicidade aditiva, ou mesmo sinérgica (p. ex., toxicidade hepática ou hematológica), a associação com outros MARMD (p. ex., metotrexato) não é aconselhável.
É recomendada precaução quando a leflunomida é administrada em conjunto com outros medicamentos (para além dos AINE) metabolizados pelo CYP2C9, tais como a fenitoína, a varfarina, fenprocumon e a tolbutamida.
Alteração da terapêutica para outros medicamentos
Como a leflunomida persiste durante muito tempo no corpo, a mudança de tratamento para outro MARMD (p.ex., metotrexato) sem cumprir o procedimento de washout pode levantar a possibilidade de riscos adicionais mesmo durante um longo período de tempo após a mudança (i.e., interacção cinética, toxicidade orgânica).
Do mesmo modo, a realização recente de tratamento com medicamentos com toxicidade hepática ou hematológica (p. ex., metotrexato) pode resultar num aumento dos efeitos indesejáveis; consequentemente, o início da terapêutica com leflunomida deve ser considerado com precaução, tendo em atenção estes aspetos de benefício/risco, e recomenda-se uma monitorização mais rigorosa na fase inicial após a mudança.
Reacções cutâneas
Em caso de estomatite ulcerosa, a administração de leflunomida deve ser interrompida.
Foram descritos casos muito raros de síndrome de Stevens-Johnson ou necrose epidérmica tóxica em doentes medicados com leflunomida.
Logo que sejam observadas reacções cutâneas ou nas mucosas suspeitas de qualquer destas reacções graves, o tratamento com leflunomida ou com quaisquer outros fármacos possivelmente associados deve ser interrompido, dando-se de imediato início a um procedimento de washout da leflunomida.
Nestes casos, é essencial um washout completo e a reexposição à leflunomida está contra-indicada.
Psoríase postular e agravamento da psoríase têm sido notificados após o uso de leflunomida.
A descontinuação do tratamento pode ser considerada tendo em conta a doença dos doentes bem como os seus antecedentes.
Infecções
Sabe-se que os medicamentos que possuem propriedades imunosupressoras – como a leflunomida – podem provocar um aumento da susceptibilidade às infecções, incluindo infecções oportunistas.
A natureza da gravidade das infecções pode ser aumentada e exigir, portanto, um tratamento precoce e enérgico.
Na eventualidade de ocorrerem infecções graves e não controladas, poderá ser necessário interromper o tratamento com leflunomida e iniciar um procedimento de washout, tal como descrito a seguir.
Casos raros de Leucoencefalopatia Progressiva Multifocal (LPM) têm sido notificados em doentes em tratamento com leflunomida entre outros imunosupressores.
Os doentes com reacção à tuberculina devem ser cuidadosamente monitorizados, em virtude do risco de reactivação da tuberculose.
Reacções respiratórias
Foi notificada doença pulmonar intersticial durante o tratamento com a leflunomida.
O risco desta ocorrer encontra-se aumentado em doentes com antecedentes de doença pulmonar intersticial.
A doença pulmonar intersticial é um distúrbio potencialmente fatal, que pode ocorrer duma forma aguda durante a terapêutica.
Sintomas pulmonares, tais como tosse e dispneia, podem ser justificação para descontinuar a terapêutica e além disso fazer uma investigação, como apropriado.
Neuropatia periférica
Foram notificados casos de neuropatia periférica em doentes a receber tratamento com leflunomida.
A maioria dos doentes recuperou após a descontinuação do tratamento com leflunomida, mas alguns doentes tiveram sintomas persistentes.
Em doentes com idade superior a 60 anos com medicação concomitante neurotóxica e diabetes, pode ocorrer um aumento do risco de neuropatia periférica.
Caso um doente a tomar leflunomida desenvolva neuropatia periférica deve-se considerar descontinuar o tratamento com leflunomida e realizar o procedimento de eliminação do medicamento.
Pressão arterial
A pressão arterial, deve ser verificada antes do início do tratamento e em seguida, periodicamente.
Reprodução (recomendações para os homens)
Os doentes do sexo masculino devem ter conhecimento de que há uma toxicidade fetal possível mediada pelos homens.
Deve ser assegurada uma contracepção efectiva durante o tratamento com leflunomida.
Não existem dados específicos quanto ao risco de toxicidade fetal mediado pelo homem.
Contudo, estudos animais para avaliar este risco específico não foram efectuados.
Para minimizar qualquer possível risco, os homens que desejam ter um filho, devem considerar a interrupção da leflunomida e tomar 8 g de colestiramina 3 vezes por dia durante 11 dias ou 50 g de carvão activado em pó, 4 vezes por dia durante 11 dias.
Em qualquer dos casos, a concentração plasmática do A771726 é então medida pela primeira vez.
Em seguida, a concentração plasmática do A771726 deve ser determinada novamente após um intervalo de pelo menos 14 dias.
Se ambas as concentrações plasmáticas estiverem abaixo de 0.02 mg/l, e após um período de espera de pelo menos 3 meses, o risco de toxicidade fetal é muito baixo.
Procedimento de washout:
Deve ser administrada uma dose de 8 g de colestiramina 3 vezes por dia.
Em alternativa, 50 g de carvão em pó activado devem ser administrados 4 vezes por dia.
A duração de um procedimento de washout completo é, habitualmente, de 11 dias.
A duração do procedimento pode ser modificada, de acordo com variáveis clínicas ou laboratoriais.
O metabólito activo da leflunomida, A771726, tem uma semi-vida longa (habitualmente 1 a 4 semanas).
Podem ocorrer acontecimentos adversos graves (por exemplo, toxicidade hepática, toxicidade hematológica ou reacções alérgicas), mesmo quando o tratamento com leflunomida é interrompido.
Consequentemente, quando este tipo de efeitos tóxicos ocorre ou, se por qualquer razão é necessário remover rapidamente do organismo o A771726, o procedimento de washout terá de ser seguido.
O procedimento poderá ser repetido se clinicamente necessário.
Para mais detalhes sobre os procedimentos de washout e outras medidas recomendadas em caso de gravidez desejada ou inesperada.
Reacções hepáticas
Foram notificados casos raros de lesões hepáticas graves, incluindo casos com desfecho fatal, durante o tratamento com leflunomida.
A maioria dos casos ocorreu durante os primeiros 6 meses de tratamento.
O tratamento concomitante com outros medicamentos hepatotóxicos foi frequentemente observado nestes casos.
É considerado essencial uma adesão rigorosa às recomendações de monitorização.
A ALT (SGPT) deve ser controlada antes do início do tratamento com leflunomida e com a mesma frequência que o hemograma completo (de 2 em 2 semanas), durante os primeiros 6 meses de tratamento, e posteriormente de 8 em 8 semanas.
Em caso de elevações da ALT (SGPT) entre 2 a 3 vezes acima do limite superior do normal, pode considerar-se uma redução da dose de 20 mg para 10 mg e a monitorização deverá ser realizada semanalmente.
Se persistirem elevações de ALT (SGPT) de mais de 2 vezes acima do limite superior do normal, ou se registarem elevações de ALT superiores a 3 vezes o limite superior do normal, a leflunomida deve ser interrompida e deve ser iniciado o procedimento de washout.
É recomendável manter a monitorização das enzimas hepáticas após descontinuação do tratamento com leflunomida, até que os valores das enzimas hepáticas tenham normalizado.
Devido a um potencial para efeitos hepatotóxicos aditivos, recomenda-se que o consumo de álcool seja evitado durante o tratamento com leflunomida.
Uma vez que o metabólito activo da leflunomida, A771726 está altamente ligado às proteínas e é excretado por metabolismo hepático e secreção biliar, é de esperar que os níveis plasmáticos de A771726 estejam aumentados em doentes com hipoproteinémia.
A leflunomida está contra-indicada em doentes com hipoproteinémia grave ou insuficiência hepática.
Reacções hematológicas
Antes do início do tratamento com leflunomida, e simultâneamente com a ALT deve ser efectuado um hemograma completo, incluindo a contagem diferencial dos leucócitos e plaquetas.
Estas análises devem ser repetidas de 2 em 2 semanas, durante os primeiros 6 meses de terapêutica, e de 8 em 8 semanas, daí em diante.
Nos doentes com anemia, leucopénia e/ou trombocitopénia pré-existentes, assim como nos doentes com insuficiência da medula óssea ou nos doentes em risco de supressão medular, o risco de distúrbios hematológicos encontra-se aumentado.
Se este tipo de reacção ocorrer, deve ser considerado um período de washout, de modo a reduzir os níveis plasmáticos de A771726.
Nos casos de reacções hematológicas graves, incluindo a pancitopénia, o tratamento com leflunomida ou com quaisquer outros fármacos mielossupressores deve ser interrompido, dando-se início a um procedimento de washout da leflunomida.
Associação com outras terapêuticas
A utilização de leflunomida em conjunto com os antimaláricos utilizados nas doenças reumatológicas (p. ex., cloroquina e hidroxicloroquina), sais de ouro intramusculares e orais, D-penicilamina, azatioprina e outros agentes imunossupressores (com excepção do metotrexato) não foi ainda estudada.
O risco associado à terapêutica combinada, em particular nos casos de tratamento a longo prazo, é desconhecido.
Uma vez que este tipo de tratamentos pode condicionar toxicidade aditiva, ou mesmo sinérgica (p. ex., toxicidade hepática ou hematológica), a associação com outros MARMD (p. ex., metotrexato) não é aconselhável.
É recomendada precaução quando a leflunomida é administrada em conjunto com outros medicamentos (para além dos AINE) metabolizados pelo CYP2C9, tais como a fenitoína, a varfarina, fenprocumon e a tolbutamida.
Alteração da terapêutica para outros medicamentos
Como a leflunomida persiste durante muito tempo no corpo, a mudança de tratamento para outro MARMD (p.ex., metotrexato) sem cumprir o procedimento de washout pode levantar a possibilidade de riscos adicionais mesmo durante um longo período de tempo após a mudança (i.e., interacção cinética, toxicidade orgânica).
Do mesmo modo, a realização recente de tratamento com medicamentos com toxicidade hepática ou hematológica (p. ex., metotrexato) pode resultar num aumento dos efeitos indesejáveis; consequentemente, o início da terapêutica com leflunomida deve ser considerado com precaução, tendo em atenção estes aspetos de benefício/risco, e recomenda-se uma monitorização mais rigorosa na fase inicial após a mudança.
Reacções cutâneas
Em caso de estomatite ulcerosa, a administração de leflunomida deve ser interrompida.
Foram descritos casos muito raros de síndrome de Stevens-Johnson ou necrose epidérmica tóxica em doentes medicados com leflunomida.
Logo que sejam observadas reacções cutâneas ou nas mucosas suspeitas de qualquer destas reacções graves, o tratamento com leflunomida ou com quaisquer outros fármacos possivelmente associados deve ser interrompido, dando-se de imediato início a um procedimento de washout da leflunomida.
Nestes casos, é essencial um washout completo e a reexposição à leflunomida está contra-indicada.
Psoríase postular e agravamento da psoríase têm sido notificados após o uso de leflunomida.
A descontinuação do tratamento pode ser considerada tendo em conta a doença dos doentes bem como os seus antecedentes.
Infecções
Sabe-se que os medicamentos que possuem propriedades imunosupressoras – como a leflunomida – podem provocar um aumento da susceptibilidade às infecções, incluindo infecções oportunistas.
A natureza da gravidade das infecções pode ser aumentada e exigir, portanto, um tratamento precoce e enérgico.
Na eventualidade de ocorrerem infecções graves e não controladas, poderá ser necessário interromper o tratamento com leflunomida e iniciar um procedimento de washout, tal como descrito a seguir.
Casos raros de Leucoencefalopatia Progressiva Multifocal (LPM) têm sido notificados em doentes em tratamento com leflunomida entre outros imunosupressores.
Os doentes com reacção à tuberculina devem ser cuidadosamente monitorizados, em virtude do risco de reactivação da tuberculose.
Reacções respiratórias
Foi notificada doença pulmonar intersticial durante o tratamento com a leflunomida.
O risco desta ocorrer encontra-se aumentado em doentes com antecedentes de doença pulmonar intersticial.
A doença pulmonar intersticial é um distúrbio potencialmente fatal, que pode ocorrer duma forma aguda durante a terapêutica.
Sintomas pulmonares, tais como tosse e dispneia, podem ser justificação para descontinuar a terapêutica e além disso fazer uma investigação, como apropriado.
Neuropatia periférica
Foram notificados casos de neuropatia periférica em doentes a receber tratamento com leflunomida.
A maioria dos doentes recuperou após a descontinuação do tratamento com leflunomida, mas alguns doentes tiveram sintomas persistentes.
Em doentes com idade superior a 60 anos com medicação concomitante neurotóxica e diabetes, pode ocorrer um aumento do risco de neuropatia periférica.
Caso um doente a tomar leflunomida desenvolva neuropatia periférica deve-se considerar descontinuar o tratamento com leflunomida e realizar o procedimento de eliminação do medicamento.
Pressão arterial
A pressão arterial, deve ser verificada antes do início do tratamento e em seguida, periodicamente.
Reprodução (recomendações para os homens)
Os doentes do sexo masculino devem ter conhecimento de que há uma toxicidade fetal possível mediada pelos homens.
Deve ser assegurada uma contracepção efectiva durante o tratamento com leflunomida.
Não existem dados específicos quanto ao risco de toxicidade fetal mediado pelo homem.
Contudo, estudos animais para avaliar este risco específico não foram efectuados.
Para minimizar qualquer possível risco, os homens que desejam ter um filho, devem considerar a interrupção da leflunomida e tomar 8 g de colestiramina 3 vezes por dia durante 11 dias ou 50 g de carvão activado em pó, 4 vezes por dia durante 11 dias.
Em qualquer dos casos, a concentração plasmática do A771726 é então medida pela primeira vez.
Em seguida, a concentração plasmática do A771726 deve ser determinada novamente após um intervalo de pelo menos 14 dias.
Se ambas as concentrações plasmáticas estiverem abaixo de 0.02 mg/l, e após um período de espera de pelo menos 3 meses, o risco de toxicidade fetal é muito baixo.
Procedimento de washout:
Deve ser administrada uma dose de 8 g de colestiramina 3 vezes por dia.
Em alternativa, 50 g de carvão em pó activado devem ser administrados 4 vezes por dia.
A duração de um procedimento de washout completo é, habitualmente, de 11 dias.
A duração do procedimento pode ser modificada, de acordo com variáveis clínicas ou laboratoriais.
Cuidados com a dieta
Leflunomida pode ser tomado com ou sem alimentos.
Não é recomendável beber álcool durante o tratamento com Leflunomida. Beber álcool enquanto toma Leflunomida pode aumentar as hipóteses de ocorrência de lesões no fígado.
Não é recomendável beber álcool durante o tratamento com Leflunomida. Beber álcool enquanto toma Leflunomida pode aumentar as hipóteses de ocorrência de lesões no fígado.
Resposta à overdose
Procurar atendimento médico de emergência, ou ligue para o Centro de intoxicações.
Sintomas
Têm sido notificados casos crónicos de sobredosagem em doentes a tomar leflunomida em doses diárias até 5 vezes a dose recomendada por dia, e notificações de sobredosagem aguda em adultos e crianças.
Na maioria dos casos notificados de sobredosagem não se verificou notificação de efeitos indesejáveis.
Efeitos indesejáveis consistentes com o perfil de segurança da leflunomida foram: dor abdominal, náuseas, diarreia, aumento das enzimas hepáticas, anemia, leucopenia, prurido e erupção cutânea.
Tratamento
Na eventualidade de ocorrer sobredosagem significativa ou toxicidade, recomenda-se a administração de colestiramina ou carvão activado, de modo a acelerar a eliminação do medicamento.
A administração de uma dose de 8 g de colestiramina por via oral, três vezes por dia, durante 24 horas, a três voluntários saudáveis, provocou uma redução dos níveis plasmáticos de A771726 de cerca de 40% no período de 24 horas e de 49 - 65% em 48 horas.
A administração de carvão activado (pó para suspensão) por via oral ou sonda nasogástrica (50 g em intervalos de 6 horas durante 24 horas), demonstrou reduzir as concentrações plasmáticas do metabólito activo A77 1726 em 37% no período de 24 horas e em 48% no período de 48 horas.
Estes procedimentos de washout podem ser repetidos nos casos em que clinicamente se justifique.
Estudos em hemodiálise e DPC (diálise peritoneal crónica ambulatória) indicam que o metabólito primário da leflunomida A771726, não é dializável.
Sintomas
Têm sido notificados casos crónicos de sobredosagem em doentes a tomar leflunomida em doses diárias até 5 vezes a dose recomendada por dia, e notificações de sobredosagem aguda em adultos e crianças.
Na maioria dos casos notificados de sobredosagem não se verificou notificação de efeitos indesejáveis.
Efeitos indesejáveis consistentes com o perfil de segurança da leflunomida foram: dor abdominal, náuseas, diarreia, aumento das enzimas hepáticas, anemia, leucopenia, prurido e erupção cutânea.
Tratamento
Na eventualidade de ocorrer sobredosagem significativa ou toxicidade, recomenda-se a administração de colestiramina ou carvão activado, de modo a acelerar a eliminação do medicamento.
A administração de uma dose de 8 g de colestiramina por via oral, três vezes por dia, durante 24 horas, a três voluntários saudáveis, provocou uma redução dos níveis plasmáticos de A771726 de cerca de 40% no período de 24 horas e de 49 - 65% em 48 horas.
A administração de carvão activado (pó para suspensão) por via oral ou sonda nasogástrica (50 g em intervalos de 6 horas durante 24 horas), demonstrou reduzir as concentrações plasmáticas do metabólito activo A77 1726 em 37% no período de 24 horas e em 48% no período de 48 horas.
Estes procedimentos de washout podem ser repetidos nos casos em que clinicamente se justifique.
Estudos em hemodiálise e DPC (diálise peritoneal crónica ambulatória) indicam que o metabólito primário da leflunomida A771726, não é dializável.
Terapêutica interrompida
Se se esquecer de tomar uma dose, tome-a assim que se lembrar, excepto se for já próximo da dose seguinte.
Não tome uma dose a dobrar para compensar uma dose que se esqueceu de tomar.
Não tome uma dose a dobrar para compensar uma dose que se esqueceu de tomar.
Cuidados no armazenamento
Não conservar acima de 30ºC.
Mantenha todos os medicamentos fora do alcance de crianças e animais de estimação.
Não deite fora quaisquer medicamentos na canalização ou no lixo doméstico. Pergunte ao seu médico, enfermeiro ou farmacêutico como deitar fora os medicamentos que já não utiliza. Estas medidas ajudarão a proteger o ambiente.
Mantenha todos os medicamentos fora do alcance de crianças e animais de estimação.
Não deite fora quaisquer medicamentos na canalização ou no lixo doméstico. Pergunte ao seu médico, enfermeiro ou farmacêutico como deitar fora os medicamentos que já não utiliza. Estas medidas ajudarão a proteger o ambiente.
Espectro de susceptibilidade e tolerância bacteriológica
Sem informação.

Vacinas vivas + Leflunomida
Observações: Por redução ou impedimento da resposta imunológica à vacinaInteracções: Evitar uso concomitante com: - Leflunomida - Leflunomida

Abatacept + Leflunomida
Observações: n.d.Interacções: Não foram identificados problemas graves de segurança com a utilização do abatacept em associação com sulfassalazina, hidroxicloroquina ou leflunomida. - Leflunomida

Leflunomida + Outros medicamentos
Observações: Os estudos de interacção só foram efetuados em adultos.Interacções: Pode registar-se um aumento dos efeitos secundários nos casos de administração recente ou concomitante de medicamentos com toxicidade hepática ou hematológica, ou quando estes medicamentos são administrados após a leflunomida sem um período de washout. Portanto, recomenda-se uma monitorização mais rigorosa das enzimas hepáticas e dos parâmetros hematológicos na fase inicial após a mudança. - Outros medicamentos

Leflunomida + Metotrexato (MTX)
Observações: Os estudos de interacção só foram efetuados em adultos.Interacções: Num pequeno estudo (n=30) usando a administração conjunta de leflunomida (10 a 20 mg por dia) e metotrexato (10 a 25 mg por semana), 5 dos 30 doentes apresentaram uma elevação de 2 a 3 vezes do nível das enzimas hepáticas. Todas estas elevações desapareceram, 2 com a continuação do medicamento e 3 após a interrupção da leflunomida. Aumentos superiores a 3 vezes foram observados noutros 5 doentes. Todos eles desapareceram também, 2 com a continuação de ambos os medicamentos e 3 após a interrupção da leflunomida. Em doentes com artrite reumatoide não foi demonstrada qualquer interacção farmacocinética entre a leflunomida (10 a 20 mg por dia) e o metotrexato (15 a 25 mg por semana). - Metotrexato (MTX)

Leflunomida + Colestiramina
Observações: Os estudos de interacção só foram efetuados em adultos.Interacções: Recomenda-se que os doentes medicados com leflunomida não sejam tratados com colestiramina ou carvão activado em pó, uma vez que esta associação determina uma baixa rápida e significativa da concentração plasmática do A771726 (o metabólito activo da leflunomida). Supõe-se que este facto seja devido a um mecanismo de interrupção da reciclagem entero-hepática e/ou a uma diálise gastrointestinal do A771726. - Colestiramina

Leflunomida + Carvão activado
Observações: Os estudos de interacção só foram efetuados em adultos.Interacções: Recomenda-se que os doentes medicados com leflunomida não sejam tratados com colestiramina ou carvão activado em pó, uma vez que esta associação determina uma baixa rápida e significativa da concentração plasmática do A771726 (o metabólito activo da leflunomida). Supõe-se que este facto seja devido a um mecanismo de interrupção da reciclagem entero-hepática e/ou a uma diálise gastrointestinal do A771726. - Carvão activado

Leflunomida + Anti-inflamatórios não esteróides (AINEs)
Observações: Os estudos de interacção só foram efetuados em adultos.Interacções: Se o doente já estiver medicado com anti-inflamatórios não esteróides (AINE) e/ou corticosteróides, estes medicamentos podem ser continuados após o início do tratamento com leflunomida. As enzimas envolvidas no metabolismo da leflunomida e dos seus metabólitos não são conhecidas com precisão. Estudos in vitro indicam que o A771726 inibe a actividade do citocromo P4502C9 (CYP2C9). Em ensaios clínicos, não foram observados problemas de segurança quando a leflunomida e AINE metabolizados pelo CYP2C9, foram administrados concomitantemente. Recomenda-se precaução quando a leflunomida é administrada em conjunto com medicamentos (para além dos AINE) metabolizados pelo CYP2C9, como a fenitoína, a varfarina, fenprocumon e a tolbutamida. - Anti-inflamatórios não esteróides (AINEs)

Leflunomida + Corticosteróides
Observações: Os estudos de interacção só foram efetuados em adultos.Interacções: Se o doente já estiver medicado com anti-inflamatórios não esteróides (AINE) e/ou corticosteróides, estes medicamentos podem ser continuados após o início do tratamento com leflunomida. As enzimas envolvidas no metabolismo da leflunomida e dos seus metabólitos não são conhecidas com precisão. - Corticosteróides

Leflunomida + Cimetidina
Observações: Os estudos de interacção só foram efetuados em adultos.Interacções: Um estudo de interacção in vivo com a cimetidina (inibidor não específico do citocromo P450) demonstrou a ausência de uma interacção significativa. - Cimetidina

Leflunomida + Rifampicina (rifampina)
Observações: Os estudos de interacção só foram efetuados em adultos.Interacções: Após uma administração concomitante de uma dose única de leflunomida a indivíduos medicados com doses múltiplas de rifampicina (indutor não específico do citocromo P450), os níveis máximos do A771726 aumentaram cerca de 40%, enquanto que a AUC não se alterou significativamente. O mecanismo deste efeito não está esclarecido. - Rifampicina (rifampina)

Leflunomida + Fenitoína
Observações: Os estudos de interacção só foram efetuados em adultos.Interacções: Estudos in vitro indicam que o A771726 inibe a actividade do citocromo P4502C9 (CYP2C9). Em ensaios clínicos, não foram observados problemas de segurança quando a leflunomida e AINE metabolizados pelo CYP2C9, foram administrados concomitantemente. Recomenda-se precaução quando a leflunomida é administrada em conjunto com medicamentos (para além dos AINE) metabolizados pelo CYP2C9, como a fenitoína, a varfarina, fenprocumon e a tolbutamida. - Fenitoína

Leflunomida + Varfarina
Observações: Os estudos de interacção só foram efetuados em adultos.Interacções: Estudos in vitro indicam que o A771726 inibe a actividade do citocromo P4502C9 (CYP2C9). Em ensaios clínicos, não foram observados problemas de segurança quando a leflunomida e AINE metabolizados pelo CYP2C9, foram administrados concomitantemente. Recomenda-se precaução quando a leflunomida é administrada em conjunto com medicamentos (para além dos AINE) metabolizados pelo CYP2C9, como a fenitoína, a varfarina, fenprocumon e a tolbutamida. - Varfarina

Leflunomida + Femprocumona
Observações: Os estudos de interacção só foram efetuados em adultos.Interacções: Estudos in vitro indicam que o A771726 inibe a actividade do citocromo P4502C9 (CYP2C9). Em ensaios clínicos, não foram observados problemas de segurança quando a leflunomida e AINE metabolizados pelo CYP2C9, foram administrados concomitantemente. Recomenda-se precaução quando a leflunomida é administrada em conjunto com medicamentos (para além dos AINE) metabolizados pelo CYP2C9, como a fenitoína, a varfarina, fenprocumon e a tolbutamida. - Femprocumona

Leflunomida + Tolbutamida
Observações: Os estudos de interacção só foram efetuados em adultos.Interacções: Estudos in vitro indicam que o A771726 inibe a actividade do citocromo P4502C9 (CYP2C9). Em ensaios clínicos, não foram observados problemas de segurança quando a leflunomida e AINE metabolizados pelo CYP2C9, foram administrados concomitantemente. Recomenda-se precaução quando a leflunomida é administrada em conjunto com medicamentos (para além dos AINE) metabolizados pelo CYP2C9, como a fenitoína, a varfarina, fenprocumon e a tolbutamida. - Tolbutamida

Leflunomida + Contraceptivos orais
Observações: Os estudos de interacção só foram efetuados em adultos.Interacções: Num estudo em que a leflunomida foi administrada conjuntamente com uma pílula contracetiva oral trifásica contendo 30 μ g de etinilestradiol a voluntários saudáveis, não houve redução da actividade contracetiva da pílula e a farmacocinética do A771726 esteve dentro dos limites previsíveis. - Contraceptivos orais

Leflunomida + Vacinas vivas
Observações: Os estudos de interacção só foram efetuados em adultos.Interacções: Vacinações: Não existem dados clínicos sobre a eficácia e a segurança de vacinações em doentes recebendo leflunomida. Contudo, vacinações com vacinas vivas atenuadas não são recomendadas. A longa semi-vida da leflunomida deve ser considerada quando se encara a administração de uma vacina viva atenuada após interrupção da leflunomida. - Vacinas vivas

Baricitinib + Leflunomida
Observações: n.d.Interacções: Transportadores In vitro, o baricitinib é um substrato do transportador aniónico orgânico-3 (OAT3), da P-glicoproteína (Pgp), da proteína de resistência do cancro da mama (BCRP) e do transportador de extrusão de múltiplos fármacos e toxinas (MATE)2-K. Num estudo de farmacologia clínica, a administração de probenecida (um inibidor do OAT3 com forte potencial de inibição) resultou num aumento aproximadamente para o dobro da AUC(0-∞), sem alterações da tmax ou Cmax do baricitinib. Consequentemente, a dose recomendada para doentes em tratamento com inibidores do OAT3 com forte potencial de inibição, como o probenecida, é de 2 mg uma vez por dia. Não foi realizado qualquer estudo de farmacologia clínica com inibidores do OAT3 com menor potencial de inibição. O pró-fármaco leflunomida converte-se rapidamente em teriflunomida, que é um inibidor fraco do OAT3, podendo por isso provocar um aumento da exposição ao baricitinib. Uma vez que não foram realizados estudos dedicados de interacção, recomenda-se precaução quando leflunomida ou teriflunomida forem administradas concomitantemente com baricitinib. A administração concomitante dos inibidores do OAT3 ibuprofeno e diclofenac pode levar a um aumento da exposição ao baricitinib. No entanto, o seu potencial de inibição do OAT3 é inferior comparativamente ao da probenecida, pelo que não é expectável qualquer interacção clinicamente relevante. A administração concomitante de baricitinib e ciclosporina (inibidor de Pgp/BCRP) ou metotrexato (substrato de vários transportadores, incluindo OATP1B1, OAT1, OAT3, BCRP, MRP2, MRP3 e MRP4) não apresentou quaisquer efeitos clinicamente significativos sobre a exposição ao baricitinib. - Leflunomida

Metotrexato + Leflunomida
Observações: n.d.Interacções: O uso concomitante de outros fármacos com potencial nefrotóxico, mielotóxico ou hepatotóxico tais como Leflunomida, Azatioprina, Sulfalazina, Retinóides e Álcool deve ser evitado. - Leflunomida

Informação revista e atualizada pela equipa técnica do INDICE.EU em: 11 de Novembro de 2021